Чёрный-чёрный азот: об одном парадоксе таблицы Менделеева
Долгие годы азот считался «неудачником» в мире химиков. Элемент никак не хотел на практике проявлять свойств, предсказанных ему периодическим законом таблицы Менделеева. Ученые почти смирились с ненавистным словом «исключение», но в результате упорных и долгих исследований им удалось добиться от азота исполнения предначертанного ему пути.

Таблица химических элементов, носящая имя великого русского химика Дмитрия Ивановича Менделеева, не просто так называется периодической. В ней различные вещества расположены в порядке возрастания количества протонов в атомных ядрах. Число протонов равно числу электронов. От расположения электронов на внешних электронных оболочках зависят химические свойства — способность атомов одних веществ образовывать связи с атомами других.
Усложнение электронных оболочек напоминает формирование человеческих навыков. Сначала ребенок учится двигать ножками, вскоре начинает ползать, затем ходить и только потом — бегать. Ни один индивид на свете не получил медаль за марафонскую дистанцию, прежде чем впервые коснулся крохотными пятками пола. Конфигурация электронов идет от простого к сложному. Условно, электронная оболочка последующих элементов — это оболочка предыдущего плюс новый электрон. Вопрос лишь в том — куда он попадет.
Как человек не может получить бесконечное число навыков за одну жизнь, так и элементы не могут иметь бесконечное число электронов на одной оболочке. В следующих «жизнях» или периодах таблицы Менделеева все начинается сначала: «ползать, ходить, бегать». Элементы с одинаковым расположением электронов на самых внешних оболочках находятся в гениальной таблице строго друг под другом. Эти столбцы называются группами, тогда как строки — периодами. Элементы в группе проявляют похожие химические свойства. Но в «семье», как говорится, не без азота.
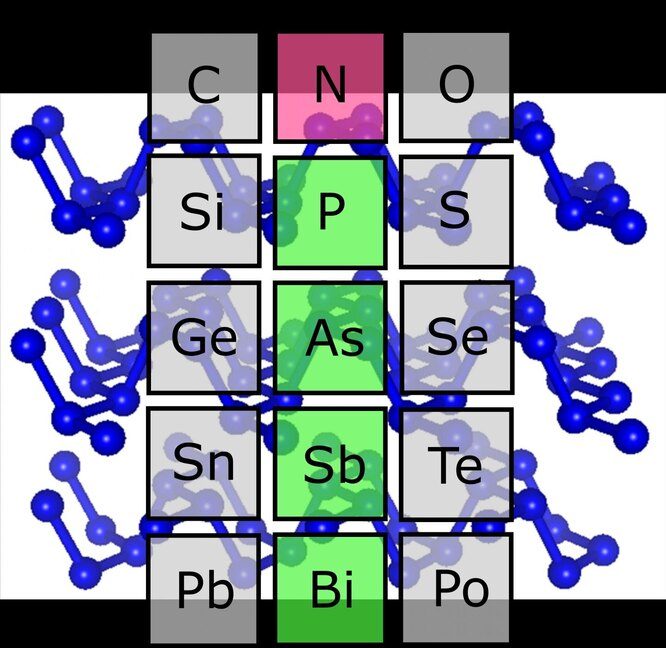
Азот — самый легкий элемент в своей группе, и он даже под высоким давлением не формировал вещества, структурно схожие с теми, которые формировали при экстремальных условиях товарищи по группе: фосфор, мышьяк и сурьма. Выстраивание атомов элементов одной группы в похожие кристаллические решетки при повышенном давлении и температуре замечено в соседний группах, возглавляемых углеродом и кислородом. Азот же до недавнего времени считался в сообществе химических элементов чем-то вроде паршивой овцы.
Из «белой вороны» в черную азот «перекрасили» исследователи из Баварского научно-исследовательского института экспериментальной геохимии и геофизики (BGI) и лаборатории кристаллографии в Университете Байройта. С помощью алмазной наковальни ученые выяснили, каких значений должны достичь температура и давление в веществе, чтобы атомы азота образовали структуру, характерную для черного фосфора и встречающуюся также у сурьмы и мышьяка. В этой многослойной структуре атомы расположены в зигзагообразном порядке. Свойства подобной структурной модификации элементов группы азота напоминают свойства графена — перспективного материала для множества применений в науке и технике.

В работе, опубликованной в 2020 году в Physical Review Letters, исследователи так и назвали наконец-то обнаруженную в эксперименте структурную модификацию — черный азот. С точки зрения применений, черный азот намного «чернее» фосфора — то есть интереснее для ученых. Свойства сжатого азота не одинаковы в различных геометрических направлениях, а ученые очень любят подобные анизотропные штучки.
К сожалению, в нормальных условиях черный азот долго не живет. Для существования ему необходимо давление, почти в 1,5 миллиона раз выше атмосферного, и температура выше 4000 градусов по Цельсию. Мощный удар двумя алмазами с противоположных сторон лишь на мгновение смог утащить азот «на темную сторону». Мига хватило, чтобы оправдать элемент перед химическим сообществом. Короткая рентгеновская вспышка просветила сжатый образец, и образование структуры подтвердилось.
Люди пока не могут выжать из таблицы Менделеева весь потенциал и вынудить элементы проявлять все предсказанные теоретически свойства. Однако это не означает, что в таблице куча исключений и парадоксов. По крайней мере, на один теперь точно меньше.

Таблица химических элементов, носящая имя великого русского химика Дмитрия Ивановича Менделеева, не просто так называется периодической. В ней различные вещества расположены в порядке возрастания количества протонов в атомных ядрах. Число протонов равно числу электронов. От расположения электронов на внешних электронных оболочках зависят химические свойства — способность атомов одних веществ образовывать связи с атомами других.
Усложнение электронных оболочек напоминает формирование человеческих навыков. Сначала ребенок учится двигать ножками, вскоре начинает ползать, затем ходить и только потом — бегать. Ни один индивид на свете не получил медаль за марафонскую дистанцию, прежде чем впервые коснулся крохотными пятками пола. Конфигурация электронов идет от простого к сложному. Условно, электронная оболочка последующих элементов — это оболочка предыдущего плюс новый электрон. Вопрос лишь в том — куда он попадет.
Как человек не может получить бесконечное число навыков за одну жизнь, так и элементы не могут иметь бесконечное число электронов на одной оболочке. В следующих «жизнях» или периодах таблицы Менделеева все начинается сначала: «ползать, ходить, бегать». Элементы с одинаковым расположением электронов на самых внешних оболочках находятся в гениальной таблице строго друг под другом. Эти столбцы называются группами, тогда как строки — периодами. Элементы в группе проявляют похожие химические свойства. Но в «семье», как говорится, не без азота.

Азот — самый легкий элемент в своей группе, и он даже под высоким давлением не формировал вещества, структурно схожие с теми, которые формировали при экстремальных условиях товарищи по группе: фосфор, мышьяк и сурьма. Выстраивание атомов элементов одной группы в похожие кристаллические решетки при повышенном давлении и температуре замечено в соседний группах, возглавляемых углеродом и кислородом. Азот же до недавнего времени считался в сообществе химических элементов чем-то вроде паршивой овцы.
Из «белой вороны» в черную азот «перекрасили» исследователи из Баварского научно-исследовательского института экспериментальной геохимии и геофизики (BGI) и лаборатории кристаллографии в Университете Байройта. С помощью алмазной наковальни ученые выяснили, каких значений должны достичь температура и давление в веществе, чтобы атомы азота образовали структуру, характерную для черного фосфора и встречающуюся также у сурьмы и мышьяка. В этой многослойной структуре атомы расположены в зигзагообразном порядке. Свойства подобной структурной модификации элементов группы азота напоминают свойства графена — перспективного материала для множества применений в науке и технике.

В работе, опубликованной в 2020 году в Physical Review Letters, исследователи так и назвали наконец-то обнаруженную в эксперименте структурную модификацию — черный азот. С точки зрения применений, черный азот намного «чернее» фосфора — то есть интереснее для ученых. Свойства сжатого азота не одинаковы в различных геометрических направлениях, а ученые очень любят подобные анизотропные штучки.
К сожалению, в нормальных условиях черный азот долго не живет. Для существования ему необходимо давление, почти в 1,5 миллиона раз выше атмосферного, и температура выше 4000 градусов по Цельсию. Мощный удар двумя алмазами с противоположных сторон лишь на мгновение смог утащить азот «на темную сторону». Мига хватило, чтобы оправдать элемент перед химическим сообществом. Короткая рентгеновская вспышка просветила сжатый образец, и образование структуры подтвердилось.
Люди пока не могут выжать из таблицы Менделеева весь потенциал и вынудить элементы проявлять все предсказанные теоретически свойства. Однако это не означает, что в таблице куча исключений и парадоксов. По крайней мере, на один теперь точно меньше.
Только зарегистрированные и авторизованные пользователи могут оставлять комментарии.
+1
Интересно.
- ↓
+6
При таком давлении газообразный водород приобретает свойства металла, включая электропроводимость. Чем газ азот отличается газа водорода? Немногим. Фосфор, мышьяк и сурьма- это не газы, сравнивать оные и искать физические сходства с газообразным азотом попросту некорректно.
- ↓