9 магических гифок, после которых вы по уши влюбитесь в химию
С чего нужно начинать уроки химии в школе…

1. Метан

Газообразный метан легче воздуха, поэтому образованная им пена легко поднимается под потолок. Ну а яркое горение основного компонента природного газа удивлять никого не должно — то же самое можно сказать про любой лёгкий углеводород.
2. Реакция окисления люминола и гексацианоферрата (III) калия

Перед вами пример хемилюминесценции: в ходе превращения люминола наблюдается хорошо различимое человеческим глазом свечение. Красная кровяная соль выступает здесь в качестве катализатора — ту же роль, между прочим, может играть и гемоглобин, в результате чего описываемая реакция широко применяется в криминологии для обнаружения следов крови.
3. Воздушный шарик, наполненный ртутью (реакция при ударе об пол)
Ртуть — единственный металл, остающийся жидким в нормальных условиях, что позволяет залить его в воздушный шарик. Однако ртуть настолько тяжела, что даже падение шарика с небольшой высоты разорвёт его в клочья.
4. Разложение перекиси водорода, катализируемой йодидом калия
В отсутствие примесей водный раствор пероксида водорода вполне стабилен, но стоит внести в него йодид калия, как моментально начнётся разложение этих молекул. Оно сопровождается выделением молекулярного кислорода, прекрасно способствующего образованию различных пен.
5. Железо + сульфат меди
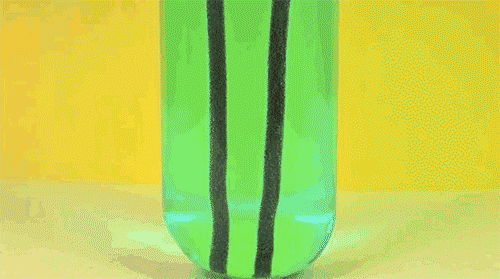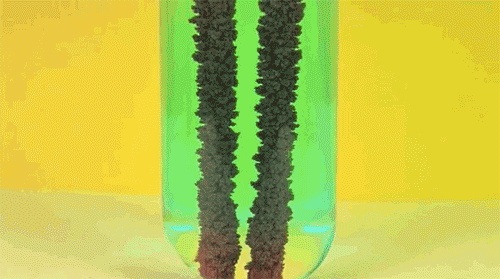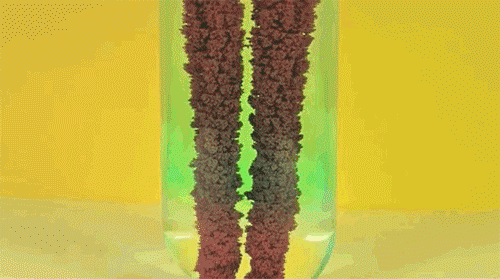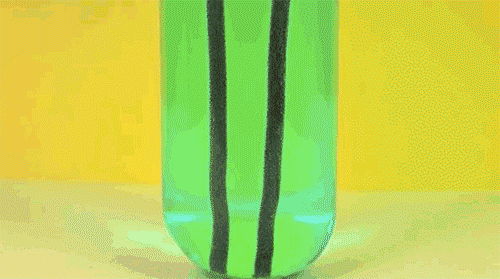
Одна из первых реакций, изучаемых в российском курсе химии: в результате замещения более активный металл (железо) растворяется и переходит в раствор, в то время как менее активный металл (медь) осаждается в виде цветных хлопьев. Как несложно догадаться, анимация сильно ускорена во времени.
6. Перекись водорода и йодистый калий
Ещё один пример реакции разложения пероксида водорода (он же перекись) в присутствие катализатора. Обратите внимание на стоящую на столе бутылку моющего средства: именно она помогает появиться падающей на стол мыльной сосиске.
7. Горение лития

Литий — один из щелочных металлов, по праву считающихся наиболее активными среди всех прочих металлов. Он горит не столь интенсивно, как его собратья натрий и калий, но нетрудно убедиться, что этот процесс всё равно весьма быстрый.
8. Обезвоживание сахара в серной кислоте

Очень простая и очень эффектная реакция: серная кислота отнимает воду у молекул сахарозы, превращая их в атомарный углерод (попросту в уголь). Выделяющаяся при этом газообразная вода вспенивает уголь, благодаря чему мы видим угрожающий чёрный столб.
9. Кварцевое стекло

В отличие от стандартного оконного стекла, кварц более устойчив к высоким температурам: он не будет «течь» на обычной газовой горелке. Именно поэтому кварцевые трубки спаивают на кислородных горелках, обеспечивающих более высокую температуру пламени.

1. Метан

Газообразный метан легче воздуха, поэтому образованная им пена легко поднимается под потолок. Ну а яркое горение основного компонента природного газа удивлять никого не должно — то же самое можно сказать про любой лёгкий углеводород.
2. Реакция окисления люминола и гексацианоферрата (III) калия

Перед вами пример хемилюминесценции: в ходе превращения люминола наблюдается хорошо различимое человеческим глазом свечение. Красная кровяная соль выступает здесь в качестве катализатора — ту же роль, между прочим, может играть и гемоглобин, в результате чего описываемая реакция широко применяется в криминологии для обнаружения следов крови.
3. Воздушный шарик, наполненный ртутью (реакция при ударе об пол)

Ртуть — единственный металл, остающийся жидким в нормальных условиях, что позволяет залить его в воздушный шарик. Однако ртуть настолько тяжела, что даже падение шарика с небольшой высоты разорвёт его в клочья.
4. Разложение перекиси водорода, катализируемой йодидом калия

В отсутствие примесей водный раствор пероксида водорода вполне стабилен, но стоит внести в него йодид калия, как моментально начнётся разложение этих молекул. Оно сопровождается выделением молекулярного кислорода, прекрасно способствующего образованию различных пен.
5. Железо + сульфат меди
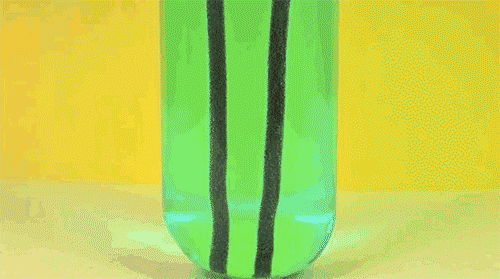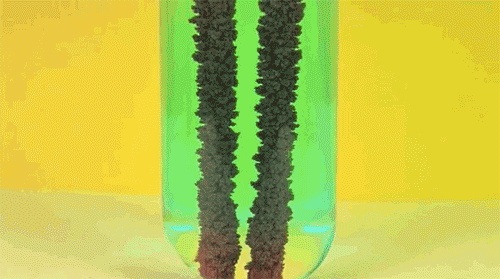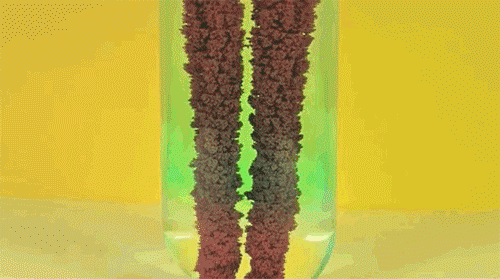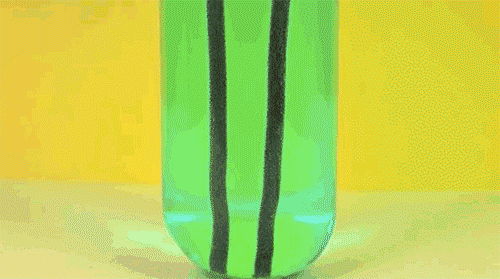
Одна из первых реакций, изучаемых в российском курсе химии: в результате замещения более активный металл (железо) растворяется и переходит в раствор, в то время как менее активный металл (медь) осаждается в виде цветных хлопьев. Как несложно догадаться, анимация сильно ускорена во времени.
6. Перекись водорода и йодистый калий
Ещё один пример реакции разложения пероксида водорода (он же перекись) в присутствие катализатора. Обратите внимание на стоящую на столе бутылку моющего средства: именно она помогает появиться падающей на стол мыльной сосиске.7. Горение лития

Литий — один из щелочных металлов, по праву считающихся наиболее активными среди всех прочих металлов. Он горит не столь интенсивно, как его собратья натрий и калий, но нетрудно убедиться, что этот процесс всё равно весьма быстрый.
8. Обезвоживание сахара в серной кислоте

Очень простая и очень эффектная реакция: серная кислота отнимает воду у молекул сахарозы, превращая их в атомарный углерод (попросту в уголь). Выделяющаяся при этом газообразная вода вспенивает уголь, благодаря чему мы видим угрожающий чёрный столб.
9. Кварцевое стекло

В отличие от стандартного оконного стекла, кварц более устойчив к высоким температурам: он не будет «течь» на обычной газовой горелке. Именно поэтому кварцевые трубки спаивают на кислородных горелках, обеспечивающих более высокую температуру пламени.
Только зарегистрированные и авторизованные пользователи могут оставлять комментарии.
+1
Классно! А нам многое из этого показывали.
- ↓
0
Химия — страшная сила ..!
- ↓