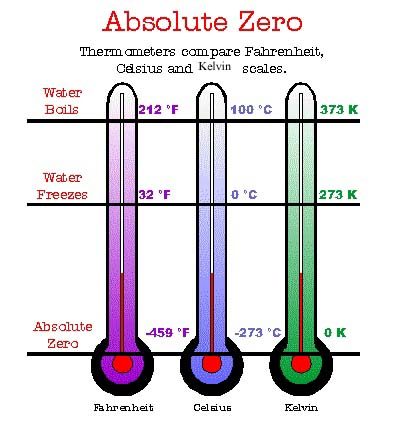
Истинная температура не может быть отрицательной
В последние годы стали всё чаще встречаться научные сообщения об экспериментальной реализации систем с отрицательной абсолютной температурой.
Хотя каждый раз ученым было понятно, о чем именно идет речь, оставалось непонятным, насколько широко этот термин разрешено использовать в термодинамике — ведь известно, что строгая термодинамика отрицательных температур не приемлет. Методическая статья, вышедшая на днях в журнале Nature Physics, расставляет вещи по своим местам.
Суть работы
В школе проходят, что абсолютная температура — та самая, которая отсчитывается от абсолютного нуля и измеряется в кельвинах, а не в градусах Цельсия, — обязана быть положительной. Однако в современной физике, а вслед за ней и в популярных материалах, сплошь и рядом встречаются статьи про экзотические системы, характеризующиеся отрицательной абсолютной температурой. Стандартный пример — коллектив атомов, каждый из которых может находиться всего в двух энергетических состояниях. Если сделать так, чтобы количество атомов в верхнем энергетическом состоянии было больше, чем в нижнем, то как бы получается отрицательная температура (рис. 1). При этом обязательно подчеркивается, что отрицательные температуры — это не очень холодные температуры, ниже абсолютного нуля, а наоборот — экстремально горячие, горячее любой положительной температуры.
Такие ситуации можно даже получать экспериментально; впервые это было сделано еще в 1951 году. Но поскольку сами эти ситуации были необычны, до поры до времени отношение ученых к этой теме было умеренно спокойное: это некое любопытное эффективное описание необычных ситуаций, но к нормальным термодинамическим системам, в которых тепло связано с пространственным движением, оно не относится.
Ситуация стала меняться в последние годы. Несколько лет назад были предсказаны системы с отрицательной температурой, связанной с движением частиц (см. новость Предсказан газ с отрицательной кинетической температурой, «Элементы», 29.08.2005), а буквально в этом году появилась статьяс экспериментальной реализацией подобной ситуации (подробности см., например, в заметке В эксперименте удалось получить устойчивую температуру ниже абсолютного нуля, «Компьюлента», 09.01.2013). Более того, ученые не просто получили такие системы, но и начали всерьез рассуждать о настоящей термодинамике с отрицательными температурами (тепловые машины с КПД выше 100%) и даже о ее возможной роли в загадке темной энергии. Таким образом, по крайней мере для части физиков, отрицательные температуры перестали казаться математическим трюком, а стали чем-то вполне реальным.
На днях в журнале Nature Physics вышла статья, которая поставила ребром вопрос о физичности термина «отрицательная температура» в настоящей термодинамике. Статья эта была, в сущности, методическая, а не исследовательская, однако в ней четко сформулированы несколько важных вещей:
Понятие температуры можно определять разными способами, и все разговоры об отрицательной температуре относятся только к одному конкретному определению. Для подавляющего большинства систем эти разные температуры практически неотличимы, поэтому неважно, каким определением пользоваться.
Для необычных систем эти температуры могут различаться, и причем — различаться кардинально. Так, обычное определение температуры может давать отрицательный результат, а другое определение — всегда положительный.
В рамках строгой термодинамики требуется, чтобы термодинамическая температура была всегда положительна. Поэтому то определение, которое приводит к отрицательным значениям, — это ненастоящая температура. Ею можно пользоваться, никто этого не запрещает, но ее нельзя подставлять в настоящие термодинамические формулы или придавать ей излишне физическое значение.
Иными словами, эта статья призывает умерить воодушевление, вызванное недавними экспериментальными достижениями.
Для неискушенного читателя это всё может показаться странным: как так — несколько температур? какая такая строгая термодинамика? Поэтому мы приводим ниже чуть более подробное, но и более техническое описание ситуации.
Подробное пояснение
Мы привыкли, что тепло — а значит, и температура как численная мера тепла — является чем-то таким осязаемым, понятным. Казалось бы, если уж в физике и есть проблемы с температурой, то они могут касаться измерения температуры в каких-то сложных случаях, но никак не ее определения. Однако новая статья говорит, что температур две и одна из них в каком-то смысле «неправильная». Как это понимать?
Для объяснения ситуации надо отступить немножко назад, отойти от прикладных аспектов термодинамики и заглянуть в ее суть, в ее аккуратную формулировку. Термодинамика — это наука о тепловых процессах, всё верно, но только понятие «температура» в ней появляется вовсе не на первом этапе. Термодинамика начинается с математики, с введения неких абстрактных величин и установления их математических свойств. Считается, что у системы есть объем, количество вещества, некая внутренняя энергия, — это всё пока еще механические характеристики, — а также новая характеристика, называемая энтропией. Именно с введения энтропии начинается термодинамика, однако что такое энтропия — на этом этапе не обсуждается. Энтропия тоже обязана обладать определенными математическими свойствами, которые можно аккуратно сформулировать как настоящие аксиомы. Желающим вкратце познакомиться с этой настоящей математической стороной вопроса можно порекомендовать статью A Guide to Entropy and the Second Law of Thermodynamics, опубликованную в математическом (!) журнале. В принципе, это всё было более-менее известно еще век назад, но в таком аккуратном математическом виде это было сформулировано лишь в последние десятилетия.
Итак, именно энтропия является той величиной, из которой следует вся привычная термодинамика. В частности, температура (а точнее, 1/T) определяется как скорость изменения энтропии с ростом внутренней энергии. И если следовать всем аксиомам термодинамики, то эта настоящая термодинамическая температура обязана быть положительной.
Всё бы хорошо, но только в этом строгом математическом построении термодинамики нет ни слова о том, чему равняется энтропия, как именно она зависит от внутренней энергии. Эта математическая формулировка является неким «универсальным вместилищем» для разнообразных реальных ситуаций, но в ней не говорится, как именно ее надо применять к конкретным системам. Возникает задача о том, как вписать реальные системы, состоящие из большого числа атомов и молекул, в термодинамику.
Этим занимается уже другая наука — статистическая физика. Это тоже очень серьезная и уважаемая дисциплина, опирающаяся на квантовую механику систем из нескольких частиц и на аккуратную математику. В частности, вы в ней можете сосчитать не только энергию коллектива из нескольких частиц, находящихся в заданной конфигурации, но и, наоборот, найти число состояний — сколько может быть разных конфигураций с заданной полной энергией. Это всё тоже хорошо, но энтропии в этой картине пока нет.
Остался один шаг — переход от статистической физики к термодинамике. Это тоже теоретический, а не экспериментальный шаг: нам надопостановить, как энтропию вычислить из числа состояний. Конечно, тут налагается требование, что вычисленная таким образом энтропия должна обладать правильными свойствами — по крайней мере, для всех жизненных ситуаций. И вот тут появляется неоднозначность: оказывается, сделать это можно по-разному.
Еще в эпоху построения статистической физики было предложено два слегка различающихся способа: энтропия по Больцману, SB, и энтропия по Гиббсу, SG. Энтропия по Больцману характеризует концентрацию энергетических состояний вблизи данной энергии, энтропия по Гиббсу — полное число состояний с энергией меньше данной энергии; см. пояснения на рис. 2. Соответственно, и температуры в этих двух картинах были разные: температура по Больцману, TB, и температура по Гиббсу, TG. Получается, можно построить две разные термодинамики для одной и той же системы.
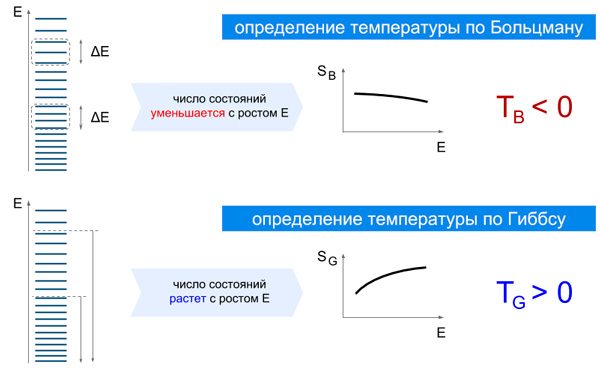
Два определения энтропии — по Больцману и по Гиббсу — могут давать сильно разные результаты для соответствующих температур. Рассмотрим систему, у которой плотность энергетических уровней уменьшается с ростом энергии. Энтропия по Больцману (SB) — это логарифм от количества уровней внутри небольшого интервала ΔE. Энтропия по Гиббсу (SG) — это логарифм от полного числа уровней ниже данной энергии. Для изображенной системы SB уменьшается с ростом энергии, а SG — растет. Поэтому температура по Больцману получается отрицательной, а по Гиббсу — положительной.
Для всех реальных ситуаций эти две термодинамики настолько близки, что их различить просто нереально. Поэтому в большинстве учебников по статистической физике и термодинамике этого различия вообще не проводится, а в качестве опоры выбирается термодинамика по Больцману. Но если соответствующую температуру TB использовать в некоторых экзотических ситуациях, то она действительно может принимать отрицательное значение. Самые простые примеры, приведенные в статье, — это стандартная ситуация (много частиц на двух энергетических уровнях) и одна-единственная квантовая частица в одномерном прямоугольном потенциале. В обоих случая непонятно, насколько вообще оправдано применение термодинамических понятий к таким системам.
Зато определение температуры по Гиббсу, TG, остается осмысленным всегда, даже в тех экзотических ситуациях, где применимость термодинамики спорна. При повышении средней энергии температура плавно растет, но никогда не становится бесконечной и не прыгает потом в отрицательные значения. Поэтому если уж мы и беремся строить термодинамику для таких систем, то надо идентифицировать настоящую температуру именно с TG, а не c TB; построенная таким образом термодинамика будет удовлетворять всем аксиомам теории.
Авторы статьи подводят итог, который очень типичен для многих спорных ситуаций в физике: можно использовать любое определение, но всегда надо помнить про сделанные при этом предположения и возникающие ограничения применимости. Стандартное определение температуры грешит тем, что оно в экзотических ситуациях перестает отвечать математическим требованиям термодинамической теории, а также не является адекватной мерой тепла. Поэтому авторы призывают физиков не придавать слишком большого значения отрицательным температурам, а в качестве более надежной опоры для сложных ситуаций они предлагают использовать определение температуры по Гиббсу. Не возбраняется также пытаться расширить границы термодинамики, придумывая некоторые обобщения этой теории, — но надо всегда помнить, что это уже будет не настоящая термодинамика и что в этих ситуациях не все настоящие термодинамические результаты работают.

Хотя каждый раз ученым было понятно, о чем именно идет речь, оставалось непонятным, насколько широко этот термин разрешено использовать в термодинамике — ведь известно, что строгая термодинамика отрицательных температур не приемлет. Методическая статья, вышедшая на днях в журнале Nature Physics, расставляет вещи по своим местам.
Суть работы
В школе проходят, что абсолютная температура — та самая, которая отсчитывается от абсолютного нуля и измеряется в кельвинах, а не в градусах Цельсия, — обязана быть положительной. Однако в современной физике, а вслед за ней и в популярных материалах, сплошь и рядом встречаются статьи про экзотические системы, характеризующиеся отрицательной абсолютной температурой. Стандартный пример — коллектив атомов, каждый из которых может находиться всего в двух энергетических состояниях. Если сделать так, чтобы количество атомов в верхнем энергетическом состоянии было больше, чем в нижнем, то как бы получается отрицательная температура (рис. 1). При этом обязательно подчеркивается, что отрицательные температуры — это не очень холодные температуры, ниже абсолютного нуля, а наоборот — экстремально горячие, горячее любой положительной температуры.
Такие ситуации можно даже получать экспериментально; впервые это было сделано еще в 1951 году. Но поскольку сами эти ситуации были необычны, до поры до времени отношение ученых к этой теме было умеренно спокойное: это некое любопытное эффективное описание необычных ситуаций, но к нормальным термодинамическим системам, в которых тепло связано с пространственным движением, оно не относится.
Ситуация стала меняться в последние годы. Несколько лет назад были предсказаны системы с отрицательной температурой, связанной с движением частиц (см. новость Предсказан газ с отрицательной кинетической температурой, «Элементы», 29.08.2005), а буквально в этом году появилась статьяс экспериментальной реализацией подобной ситуации (подробности см., например, в заметке В эксперименте удалось получить устойчивую температуру ниже абсолютного нуля, «Компьюлента», 09.01.2013). Более того, ученые не просто получили такие системы, но и начали всерьез рассуждать о настоящей термодинамике с отрицательными температурами (тепловые машины с КПД выше 100%) и даже о ее возможной роли в загадке темной энергии. Таким образом, по крайней мере для части физиков, отрицательные температуры перестали казаться математическим трюком, а стали чем-то вполне реальным.
На днях в журнале Nature Physics вышла статья, которая поставила ребром вопрос о физичности термина «отрицательная температура» в настоящей термодинамике. Статья эта была, в сущности, методическая, а не исследовательская, однако в ней четко сформулированы несколько важных вещей:
Понятие температуры можно определять разными способами, и все разговоры об отрицательной температуре относятся только к одному конкретному определению. Для подавляющего большинства систем эти разные температуры практически неотличимы, поэтому неважно, каким определением пользоваться.
Для необычных систем эти температуры могут различаться, и причем — различаться кардинально. Так, обычное определение температуры может давать отрицательный результат, а другое определение — всегда положительный.
В рамках строгой термодинамики требуется, чтобы термодинамическая температура была всегда положительна. Поэтому то определение, которое приводит к отрицательным значениям, — это ненастоящая температура. Ею можно пользоваться, никто этого не запрещает, но ее нельзя подставлять в настоящие термодинамические формулы или придавать ей излишне физическое значение.
Иными словами, эта статья призывает умерить воодушевление, вызванное недавними экспериментальными достижениями.
Для неискушенного читателя это всё может показаться странным: как так — несколько температур? какая такая строгая термодинамика? Поэтому мы приводим ниже чуть более подробное, но и более техническое описание ситуации.
Подробное пояснение
Мы привыкли, что тепло — а значит, и температура как численная мера тепла — является чем-то таким осязаемым, понятным. Казалось бы, если уж в физике и есть проблемы с температурой, то они могут касаться измерения температуры в каких-то сложных случаях, но никак не ее определения. Однако новая статья говорит, что температур две и одна из них в каком-то смысле «неправильная». Как это понимать?
Для объяснения ситуации надо отступить немножко назад, отойти от прикладных аспектов термодинамики и заглянуть в ее суть, в ее аккуратную формулировку. Термодинамика — это наука о тепловых процессах, всё верно, но только понятие «температура» в ней появляется вовсе не на первом этапе. Термодинамика начинается с математики, с введения неких абстрактных величин и установления их математических свойств. Считается, что у системы есть объем, количество вещества, некая внутренняя энергия, — это всё пока еще механические характеристики, — а также новая характеристика, называемая энтропией. Именно с введения энтропии начинается термодинамика, однако что такое энтропия — на этом этапе не обсуждается. Энтропия тоже обязана обладать определенными математическими свойствами, которые можно аккуратно сформулировать как настоящие аксиомы. Желающим вкратце познакомиться с этой настоящей математической стороной вопроса можно порекомендовать статью A Guide to Entropy and the Second Law of Thermodynamics, опубликованную в математическом (!) журнале. В принципе, это всё было более-менее известно еще век назад, но в таком аккуратном математическом виде это было сформулировано лишь в последние десятилетия.
Итак, именно энтропия является той величиной, из которой следует вся привычная термодинамика. В частности, температура (а точнее, 1/T) определяется как скорость изменения энтропии с ростом внутренней энергии. И если следовать всем аксиомам термодинамики, то эта настоящая термодинамическая температура обязана быть положительной.
Всё бы хорошо, но только в этом строгом математическом построении термодинамики нет ни слова о том, чему равняется энтропия, как именно она зависит от внутренней энергии. Эта математическая формулировка является неким «универсальным вместилищем» для разнообразных реальных ситуаций, но в ней не говорится, как именно ее надо применять к конкретным системам. Возникает задача о том, как вписать реальные системы, состоящие из большого числа атомов и молекул, в термодинамику.
Этим занимается уже другая наука — статистическая физика. Это тоже очень серьезная и уважаемая дисциплина, опирающаяся на квантовую механику систем из нескольких частиц и на аккуратную математику. В частности, вы в ней можете сосчитать не только энергию коллектива из нескольких частиц, находящихся в заданной конфигурации, но и, наоборот, найти число состояний — сколько может быть разных конфигураций с заданной полной энергией. Это всё тоже хорошо, но энтропии в этой картине пока нет.
Остался один шаг — переход от статистической физики к термодинамике. Это тоже теоретический, а не экспериментальный шаг: нам надопостановить, как энтропию вычислить из числа состояний. Конечно, тут налагается требование, что вычисленная таким образом энтропия должна обладать правильными свойствами — по крайней мере, для всех жизненных ситуаций. И вот тут появляется неоднозначность: оказывается, сделать это можно по-разному.
Еще в эпоху построения статистической физики было предложено два слегка различающихся способа: энтропия по Больцману, SB, и энтропия по Гиббсу, SG. Энтропия по Больцману характеризует концентрацию энергетических состояний вблизи данной энергии, энтропия по Гиббсу — полное число состояний с энергией меньше данной энергии; см. пояснения на рис. 2. Соответственно, и температуры в этих двух картинах были разные: температура по Больцману, TB, и температура по Гиббсу, TG. Получается, можно построить две разные термодинамики для одной и той же системы.

Два определения энтропии — по Больцману и по Гиббсу — могут давать сильно разные результаты для соответствующих температур. Рассмотрим систему, у которой плотность энергетических уровней уменьшается с ростом энергии. Энтропия по Больцману (SB) — это логарифм от количества уровней внутри небольшого интервала ΔE. Энтропия по Гиббсу (SG) — это логарифм от полного числа уровней ниже данной энергии. Для изображенной системы SB уменьшается с ростом энергии, а SG — растет. Поэтому температура по Больцману получается отрицательной, а по Гиббсу — положительной.
Для всех реальных ситуаций эти две термодинамики настолько близки, что их различить просто нереально. Поэтому в большинстве учебников по статистической физике и термодинамике этого различия вообще не проводится, а в качестве опоры выбирается термодинамика по Больцману. Но если соответствующую температуру TB использовать в некоторых экзотических ситуациях, то она действительно может принимать отрицательное значение. Самые простые примеры, приведенные в статье, — это стандартная ситуация (много частиц на двух энергетических уровнях) и одна-единственная квантовая частица в одномерном прямоугольном потенциале. В обоих случая непонятно, насколько вообще оправдано применение термодинамических понятий к таким системам.
Зато определение температуры по Гиббсу, TG, остается осмысленным всегда, даже в тех экзотических ситуациях, где применимость термодинамики спорна. При повышении средней энергии температура плавно растет, но никогда не становится бесконечной и не прыгает потом в отрицательные значения. Поэтому если уж мы и беремся строить термодинамику для таких систем, то надо идентифицировать настоящую температуру именно с TG, а не c TB; построенная таким образом термодинамика будет удовлетворять всем аксиомам теории.
Авторы статьи подводят итог, который очень типичен для многих спорных ситуаций в физике: можно использовать любое определение, но всегда надо помнить про сделанные при этом предположения и возникающие ограничения применимости. Стандартное определение температуры грешит тем, что оно в экзотических ситуациях перестает отвечать математическим требованиям термодинамической теории, а также не является адекватной мерой тепла. Поэтому авторы призывают физиков не придавать слишком большого значения отрицательным температурам, а в качестве более надежной опоры для сложных ситуаций они предлагают использовать определение температуры по Гиббсу. Не возбраняется также пытаться расширить границы термодинамики, придумывая некоторые обобщения этой теории, — но надо всегда помнить, что это уже будет не настоящая термодинамика и что в этих ситуациях не все настоящие термодинамические результаты работают.
Только зарегистрированные и авторизованные пользователи могут оставлять комментарии.